La AEMPS autoriza los ensayos clínicos en humanos de la vacuna española contra la covid-19
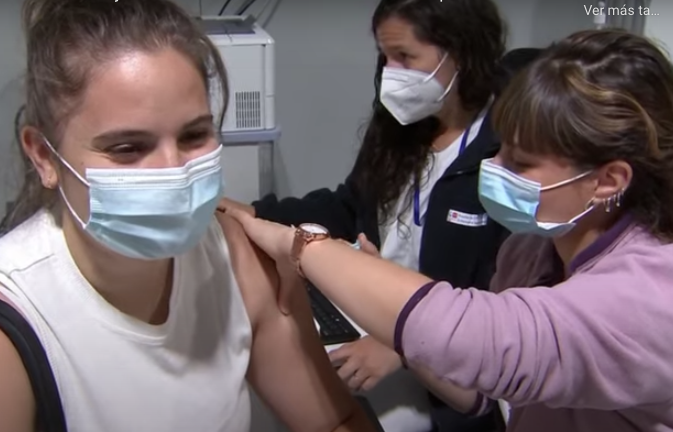
La Agencia Española del Medicamento (AEMPS) autoriza el primer ensayo clínico en humanos de la vacuna contra la COVID-19 producida en España
La vacuna, llamada PHH-1V, de la compañía Hipra, será puesta a prueba tan pronto se recluten los voluntarios suficientes en los centros hospitalarios. Hasta ahora, se trata de la primera vacuna española -de cuatro- que recibe la autorización de la Agencia.
El presidente del Gobierno, Pedro Sánchez, ha saludado la noticia durante su participación en el homenaje al escritor José Saramago en la isla de Lanzarote.
«Nuestro país ha invertido más de 13 millones de euros en transferencias y casi 6 millones de euros en préstamos para colaborar con la ciencia española en el desarrollo de nuevas vacunas contra el covid-19 en nuestro país», dijo Sánchez.
A los voluntarios se les administrará dos dosis, con tres semanas de separación, y serán seguidos por un comité independiente de vigilancia para identificar posibles efectos secundarios.
La vacuna está basada en dos proteínas recombinantes estructuralmente similares y se acompañan de un componente que incrementa su respuesta inmunológica contra el patógeno.
Hipra adelantó que los resultados previos en laboratorio fueron satisfactorios y asimismo aseguró su efectividad, incluso contra la variante delta, según los últimos ensayos.
La empresa española, situada en la ciudad de Girona, prevé producir 400 millones de dosis de su vacuna durante 2022. Y es muy probable que esté en el mercado a mediados del primer trimestre del próximo año, si logra cumplir con los requisitos de la AEMPS.
Según recoge el diario español El País, «el medicamento requiere una conservación entre los dos y los ocho grados centígrados, lo que facilita su logística y distribución».
